محصولات مشابه
ویژگی ها
توضیحات
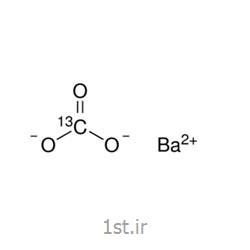
مشخصات محصول کربنات باریم:
- نام شیمیایی : کربنات باریم.
- اسامی مترادف با کربنات باریم : ویتریت، Barium carbonate، کربنات باریوم.
- گرید محصول : 1. کربنات باریم صنعتی 2. کربنات باریم آزمایشگاهی.
- فرمول شیمیایی : BaCO3.
- خلوص : کربنات باریم 99%.
- شکل ظاهری : شکل ظاهری این ترکیب، بلورهای سفید رنگ میباشد.
- حلالیت در آب : قابل حل در آب میباشد.
تاریخچه کربنات باریم:
کربنات باریم به دو شکل موجود میباشد : 1.کربنات باریم طبیعی یا ویتریت 2. کربنات باریم سنتزی. کربنات باریم یکی از دو ترکیب شیمیایی باریم میباشد که با ترکیب شیمیایی BaCO توسط کانی شناس برجسته انگلیسی به نام withering کشف شده است دیگر ترکیب مهم باریم، سولفات باریم یا باریت است. این ماده در سیستم اورتورومبیک متبلور میشود. زون آن 4/35 گرم بر سانتی متر مکعب، جلای شیشه ای و گاهی صمغی میباشد. ویتریت به رنگ سفید، متمایل به زرد و خاکستری با رنگ خاک سفید و بلورهای شفاف تا نیمه شفاف میباشد. این کانی معمولا نسبت به باریت کمیاب بوده و غالبا رگه های گالن را همراهی میکند و با اسید سولفوریک تبدیل به سولفات باریم میشود. کربنات باریم یا ویتریت به صورت همراه، در معادن باریم وجود دارد ولی کربنات باریم سنتزی، تولید صنعتی داشته و به صورت یک محصول تولیدی در واحدهای صنعتی تولید شده و عرضه میشود.
کاربرد باور نکردنی کربنات باریم:
کربنات باریم در صنایع کاربرد بسیاری دارد:
1. یکی از کاربردهای کربنات باریم در صنعت سرامیک است این ترکیب دو مورد استفادة مهم در صنایع سرامیک دارد که عبارتند از:
الف - تبدیل سولفات های محلول به سولفات باریم غیر قابل حل: ترکیب اکسید باریم در داخل سرامیک یکی از موارد استفادة کربنات باریم در ساخت وسایل سفالی پخته شده است.
درصورت عدم استفاده از کربنات باریم در ساخت این وسایل، سولفات های قابل حل موجود در سفال ها، رطوبت هوا را جذب نموده و انبساط حاصل میکنند و سرانجام خرد میشوند. علاوه بر این در اثر خشک شدن سولفات های محلول موجود در سرامیک ها، حباب هایی بر سطح سرامیک ایجاد میشود. سولفات محلول موجود در تودة سرامیکی مانع یکنواختی تودة سرامیکی و مانع چسبندگی لعاب برروی سرامیک میشود. اضافه کردن کربنات باریم به این مواد باعث تبدیل سولفات های محلول به سولفات باریم غیر قابل حل شده و مشکلات ذکر شده را بر طرف میکند. برای ساخت لعاب مورد مصرف در سرامیک نیز از کربنات باریم استفاده میشود. این ترکیب به مخلوط لعاب در جریان گداختن اضافه شده و سبب تبدیل کربنات باریم به اکسید باریم شده که این امر باعث افزایش سطح واکنش و غلظت لعاب ذوب شده میگردد و نهایتا منجر به شفافیت سطح لعاب خواهد شد.
2. کاربرد دیگر کربنات باریم در ساخت الکترو سرامیک ها است. این نوع سرامیک ها از اکسید و کربنات آهن به همراه باریم یا استرانسیم و سرب ساخته میشود. بخش کوچک ولی مهمی از کربنات باریم در این صنعت مورد استفاده قرار میگیرد.
در ساخت الکترو سرامیک ها. کربنات باریم به تیتانات باریم تبدیل میشود. این ترکیب دراثر واکنش میان کربنات باریم با اکسید تیتانیم در حالت جامد و در BaTiO2 درجة حرارت بالا بوجود میآید. مورد استفاده تیتانات باریم در ساخت دی الکتریک ها است.
3.فریت باریم نیز بخشی از مصرف کربنات باریم را تشکیل میدهد. از این ترکیبات در صنعت الکترونیک استفاده میشود و رشد این صنعت باعث افزایش میزان تقاضا برای کربنات باریم در سال های اخیر شده است.
4. تثبیت کننده چسب آهار.
5. انعقاد پلاستیک های مصنوعی.
6. تولید حشره کش ها، میکروب کش ها و سموم کشاورزی.
7. عامل ذوب کننده در جوشکاری.
8. در ذوب نمودن و تصفیه کردن منیزیم.
9. در استحصال ایندیم.
10. بازیافت روی از تفاله
11. ساخت شیشه های طبی.
روش تولید کربنات باریم:
برای تولید کربنات باریم، ابتدا سولفات باریم توسط زغال سنگ در دمای 1200 – 1000 درجه سانتی گراد و در کوره دوار به سولفید باریم احیا میشود. سپس سولفید باریم به شکل محلول با دی اکسید کربن یا کربنات سدیم واکنش میدهد که در نتیجه کربنات باریم رسوب خواهد کرد.
BaSO4 + 4C à 4BaS + 4CO
BaS + CO2 + H2Oà BaCO3 + H2S
BaS + Na2CO3à BaCO3 + Na2S
خطرات باریم کربنات
استنشاق کربنات باریم در ریه های انسان تجمع پیدا کرده و به آرامی اقدام به آسیب زدن میکند. از طرفی باعث ترشح بزاق بیش از حد، استفراغ و درد شکمی شدید شده و همچنین وزوز گوش، سرگیجه و سردرد؛ کشش عضلانی، پیشرفت به تشنج و یا فلج را حادث میشود. کربنات باریم به شدت با اسیدهای قوی واکنش داده که این موجب خطر آتش سوزی شدید میشود.
بسته بندی کربنات باریم:
کربنات باریم در کیسه های 25 کیلوگرمی موجود میباشد.
تامین کنندگان دیگر این محصول















 ضمانت سلامت فیزیکی
ضمانت سلامت فیزیکی ضمانت اصالت کالا
ضمانت اصالت کالا
















.jpg)




.jpg)
.jpg)
.jpg)



.jpg)

-Cr2O3).jpg)


